
罕见病与眼科基因治疗赛道再添重磅一笔。
近日,Aavantgarde 宣布完成 1.41 亿美元 B 轮融资,由 施罗德资本(Schroders Capital) 领投,Atlas Venture、Forbion、Amgen Ventures、Athos Capital、CDP Venture Capital、Columbia IMC、Neva SGR、Sixty Degree Capital、XGen Venture、Willett Advisors 等机构参投,现有股东 Longwood Fund 与 Sofinnova Partners 持续跟投。
这家处于临床阶段的生物技术公司,专注于开发 遗传性视网膜疾病(Inherited Retinal Diseases, IRDs) 的创新疗法,重点聚焦 Stargardt 病 与 Usher 综合征 1B 型(USH1B) 两大疾病领域。
在过去十年中,Luxturna 的获批曾标志着眼科基因治疗的里程碑,但其适用人群局限于 RPE65 突变型患者。然而,Luxturna 的价值不仅在于科学上的成功,更在于验证了眼科基因疗法的可行性与临床转化路径——
新一代平台如 Aavantgarde 正在扩大适应证边界,从“个别突变”迈向“通用基因修复”。公司管理层曾指出,“从商业角度,关键在于识别患者群体的规模与流行病学特征。相比之下,Stargardt 病和 Usher 1B 综合征都拥有更广泛的患者基础。”
据估计,全球约有 550 万黄斑营养不良患者,其中约 12%(约 66 万人)为 Stargardt 病患者;而 Usher 综合征 1B 则是最常见的 Usher 综合征亚型。
这种逻辑构成了 Aavantgarde 的战略核心——既解决技术难度极高的“大基因递送”问题,又聚焦于具有明确、可识别人群基础的疾病领域。
01|资金用途与核心管线进展
Aavantgarde 表示,本轮融资将主要用于推进两项核心临床项目:
AAVB-039 CELESTE 项目(Stargardt病):
针对由 ABCA4 基因突变 引起的 Stargardt 病的基因增强疗法。该项目已完成临床概念验证(proof-of-concept)研究及超过 100 名患者参与的自然史研究(STELLA)。
AAVB-081 LUCE 项目(Usher 1B 综合征):
由 MYO7A 基因突变 导致的视网膜色素变性,目前已完成 1/2 期临床研究的临床概念验证阶段。
Stargardt 病是年轻人中最常见的黄斑营养不良症,但至今尚无获批疗法。Aavantgarde 的 AAVB-039 项目通过基因增强技术输送全长 ABCA4 蛋白,突破了传统 AAV 载体容量受限的瓶颈,使得不同突变型患者均可受益。
Usher 综合征 1B 则是一种罕见的双重感官障碍疾病,患者不仅逐渐失明,还伴随先天性耳聋。Aavantgarde 的 AAVB-081 项目可递送全长 MYO7A 蛋白,从源头上修复基因缺陷,为这类严重患者带来潜在的治愈希望。
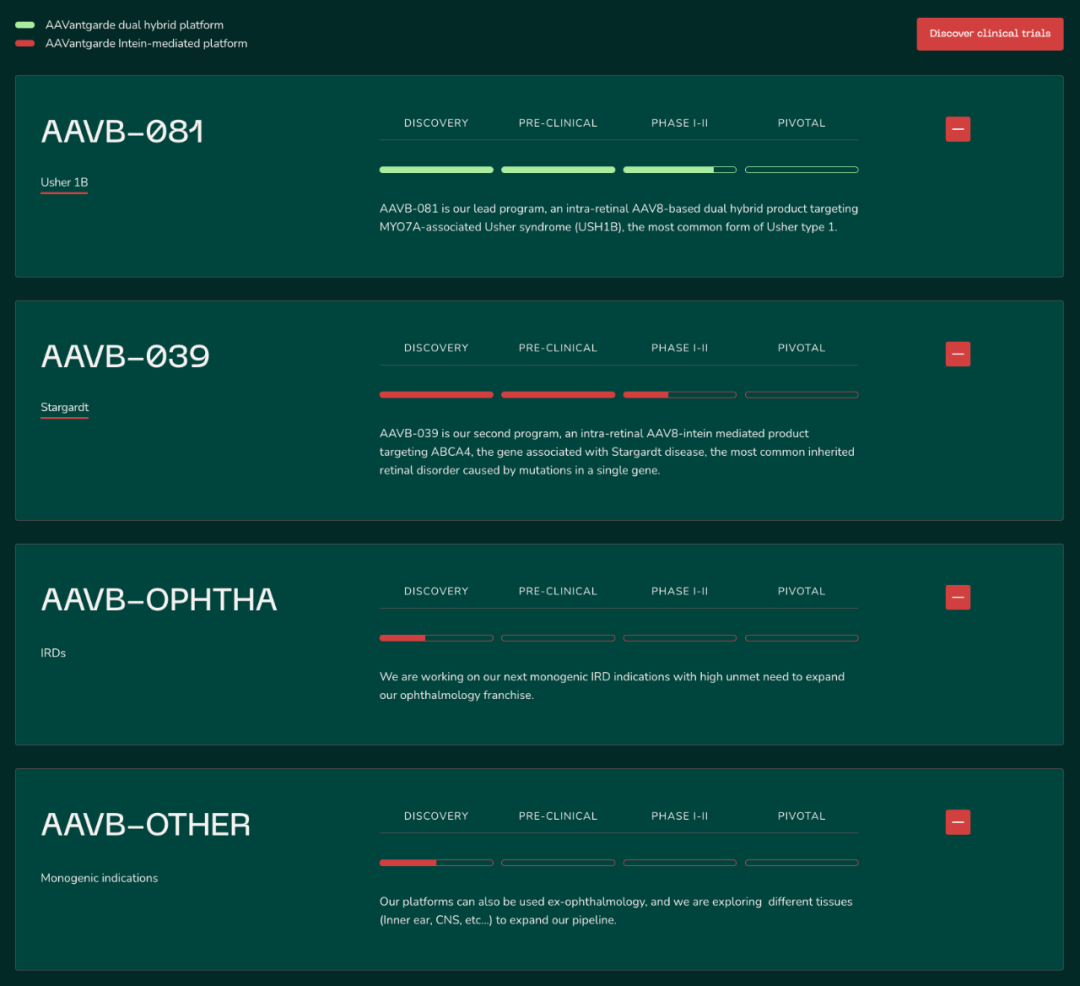
02|技术亮点:打破AAV递送的“体积极限”
Aavantgarde 的核心竞争力在于其专有大型基因递送平台,通过两大技术路径突破传统 AAV 的载荷上限(通常不超过 4.7 kb):
2.1 Dual Hybrid(双杂合)DNA 重组技术
用于递送大型基因的双向包装系统,已应用于 Usher 1B 的 MYO7A 基因。

2.2 Intein(内含肽)蛋白质反式剪接技术
通过分段表达与蛋白自组装,实现对超大基因(如 ABCA4)的有效递送,应用于 Stargardt 项目。
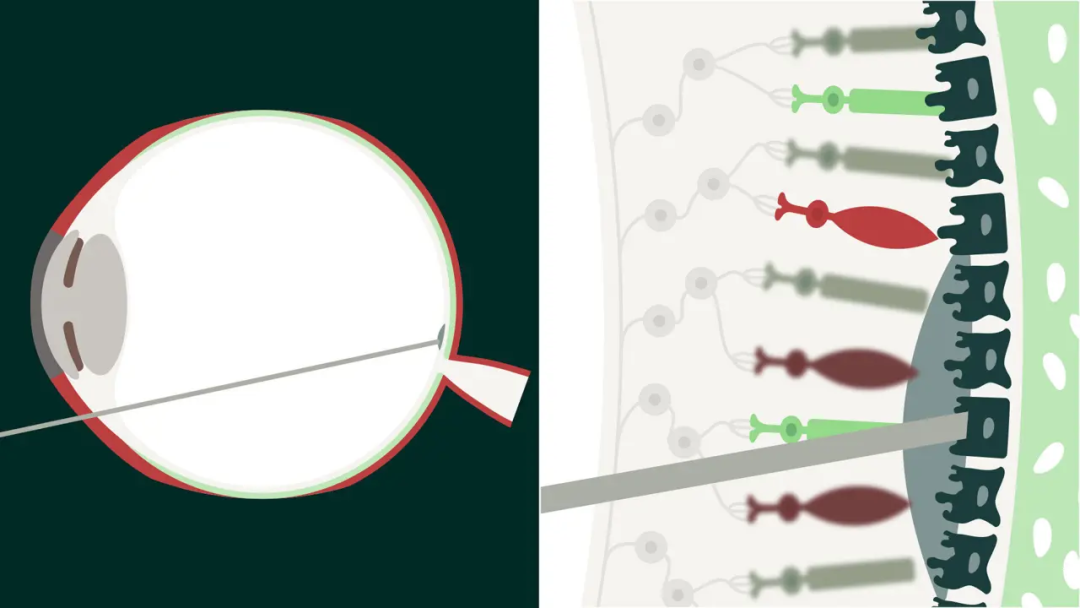
这两种策略使 Aavantgarde 能够跨越传统 AAV 载体无法容纳的基因长度限制,为一系列以“大基因为病因”的遗传病提供可复制的治疗思路。
03|研发/临床/投资多方视角:瞄准AAV“2.0时代”
“这项投资是对我们团队、科研以及两项临床项目的有力认可。”
——Aavantgarde 首席执行官 Natalia Misciattelli 博士
“遗传性视网膜病(IRD)是全球儿童和青少年失明的主要原因之一。此次融资是向可治愈方向迈出的关键一步。”
——克利夫兰诊所眼科教授 Peter Kaiser 博士(Aavantgarde 董事会成员)
“Aavantgarde 的创新平台有望克服现有 AAV 技术的关键障碍,为 Usher 1B 和 Stargardt 病等患者带来一流疗法。”
——施罗德资本英国风险投资主管
04|放眼产业:眼科药物开发的艰难与潜力
药物发现与开发是一个耗时数十年、成本极高的过程。据估计,研发一种新药的成本在 3.14 亿至 44 亿美元之间,成功率不足万分之一。
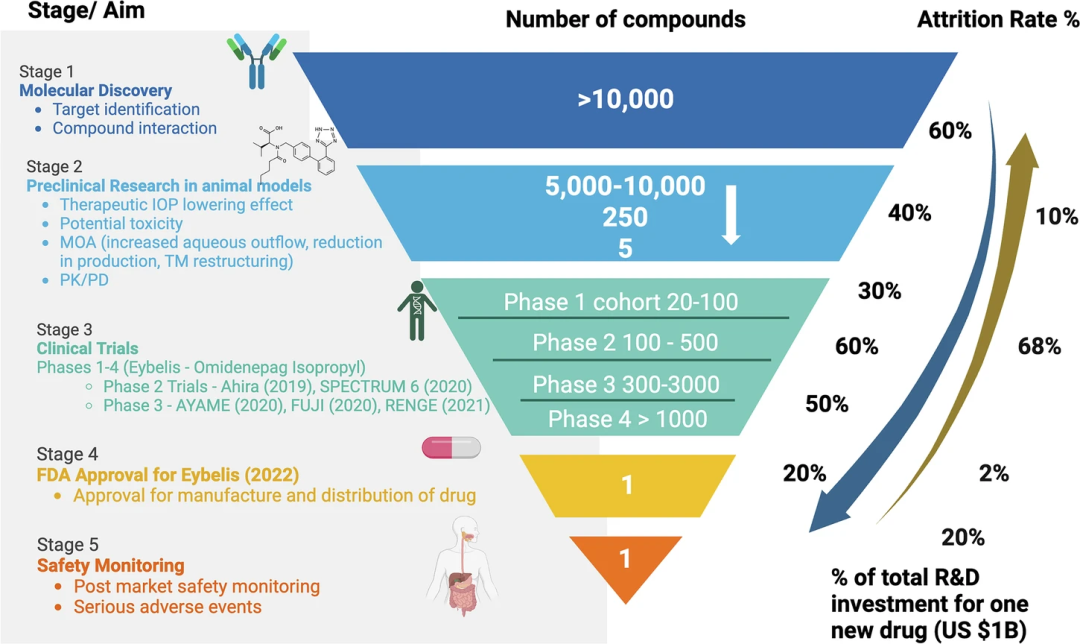
上图:概述了眼科领域药物发现与开发过程中的关键阶段、淘汰率及所需资金投入。药物开发流程始于靶点确认与化合物筛选,随后进入临床前研究阶段。该阶段会利用体外试验及体内试验,评估药物的疗效、毒性及药代动力学/药效学(PK/PD)特性。临床开发阶段分为 I 至 IV 期,受试者群体规模逐步扩大,依次评估药物的安全性、剂量、疗效及长期效果。每个阶段都面临极高的淘汰率,最终能获得批准的化合物不足万分之一。据估算,2000 至 2018 年间,成功研发一种药物的平均成本为 1.727 亿美元。药物获得监管机构批准后,还需开展上市后监测,持续评估其安全性及不良事件。奥米尼帕格异丙酯(omidenepag isopropyl,商品名 Eybelis)的案例可作为该开发流程在眼科领域的实例,该药是一种用于降低青光眼及高眼压症患者眼压(IOP)的局部用药。这种结构化流程能确保只有最具潜力且安全的治疗方案最终用于患者。预计到 2030 年,全球眼科药物市场规模将达到 660 亿美元,其中对年龄相关性黄斑变性 (AMD) 和糖尿病视网膜病变等主要致盲疾病的大量投资。从 VEGF 被确认为血管通透因子(1983 年),到 抗 VEGF 药物雷珠单抗(ranibizumab) 于 2006 年获批用于 AMD,历时超过 30 年。
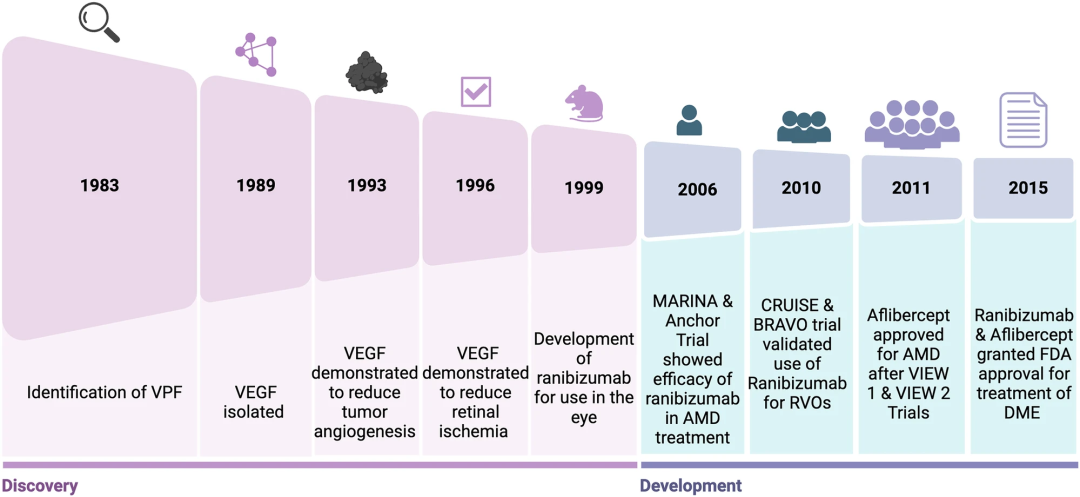
上图:展示了抗血管内皮生长因子(抗 VEGF)疗法在发现与开发过程中的关键里程碑。时间线始于 1983 年血管内皮生长因子(VEGF)被确认为血管通透因子(VPF),随后记录了1989 年 VEGF 的分离过程、1993 年其在肿瘤血管生成及1996 年在视网膜缺血中的作用,以及1999 年靶向抗 VEGF 药物雷珠单抗(ranibizumab)的研发历程。临床试验里程碑包括 2006 年针对年龄相关性黄斑变性(AMD)开展的 MARINA 研究与 ANCHOR 研究,以及 2010 年针对视网膜静脉阻塞(RVO)开展的 CRUISE 研究与 BRAVO 研究。2011 年经 VIEW 1 和 VIEW 2 研究后FDA批准阿柏西普(aflibercept)用于治疗 AMD ,2015年雷珠单抗和阿柏西普获得FDA批准用于糖尿病性黄斑水肿(DME)的治疗。这是该领域在监管与治疗层面的重要突破。贝伐珠单抗最初是为治疗癌症而开发的,在被意外“发现”并用于治疗 AMD 之前,经历了 20 多年的研发和数十亿美元的投入。
即便如此,自 2010 年以来至2023年,FDA 批准的眼科新药仅有 17 种,主要集中在 AMD、青光眼、干眼症 等领域。
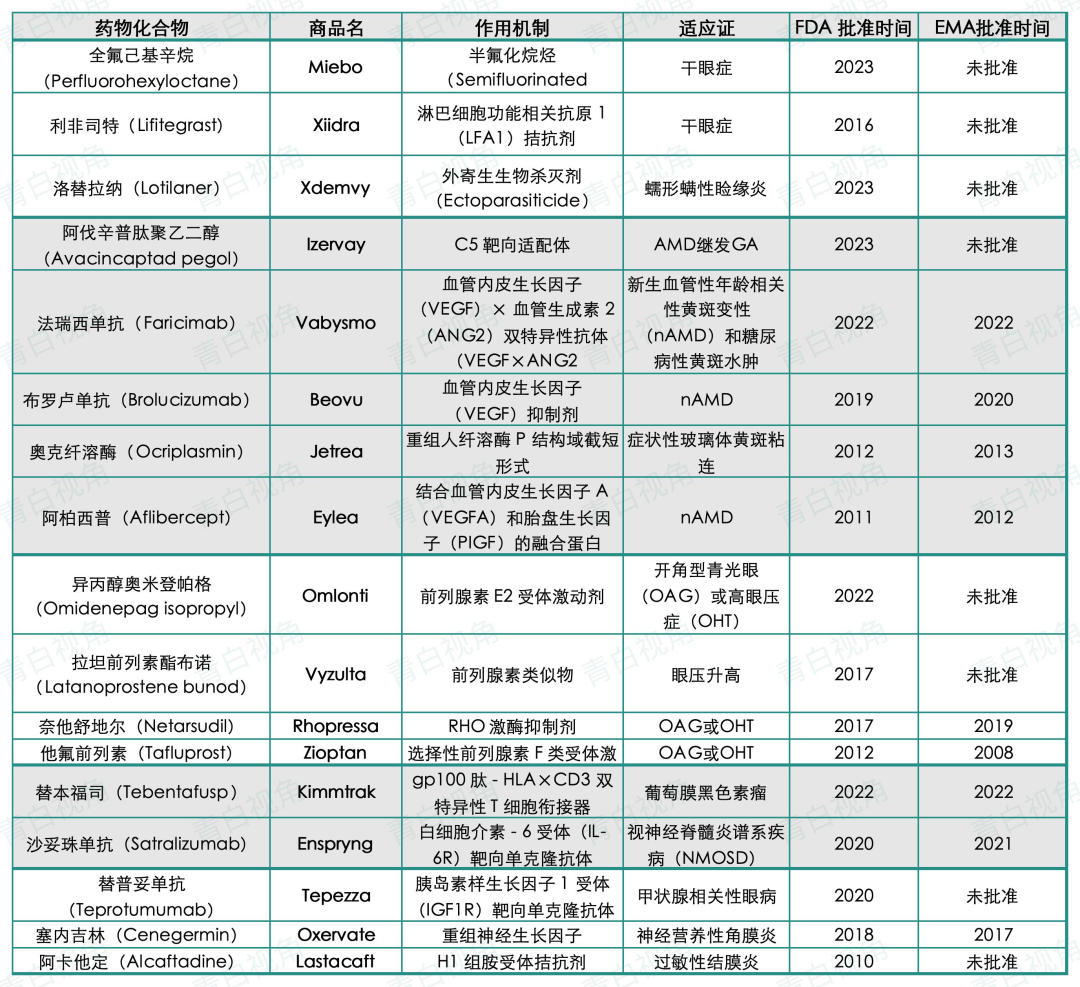
而对于如 Stargardt、Usher 综合征 等致盲性疾病,目前仍缺乏有效疗法。
这意味着——Aavantgarde 所代表的这类创新型企业,正处在遗传性眼病治疗“空白地带”的前沿,也站在了AAV疗法向更复杂疾病拓展的关键节点上。








