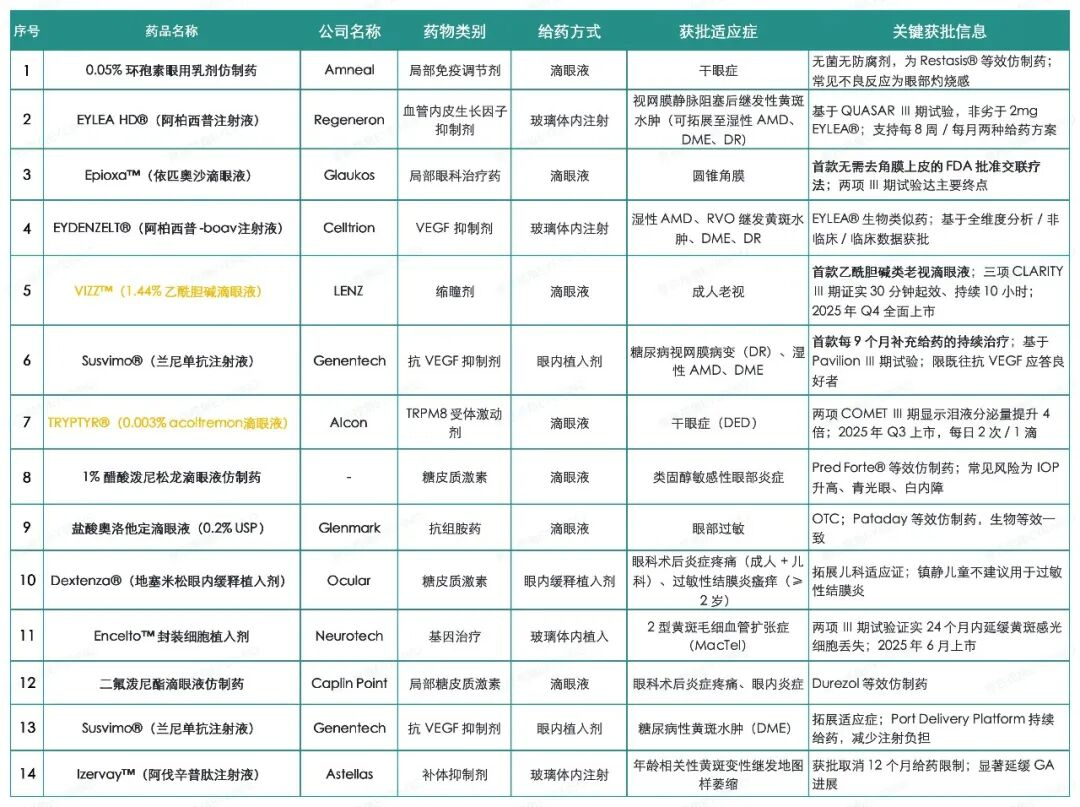
2025年美国眼科治疗领域在FDA审批层面呈现审慎而活跃的态势:全年仅有两款全新分子实体药物获批,同时生物类似药、仿制药、新剂型与新适应证拓展构成了年度进展的主体,折射出眼科药物研发向差异化与患者便利性持续深化的趋势。
一、全新分子实体:聚焦老视与干眼症
其中:2025年美国FDA获批的眼科领域“新型”药物仅有两款——用于老视的VIZZ™,以及用于干眼症的TRYPTYR®。此处“新型”特指此前从未在美国获批或上市的全新药物。



1.1 TRYPTYR®
适应证:干眼症
药物类别:瞬时受体电位M8(TRPM8)受体激动剂
给药方式:滴眼液
FDA已批准Alcon(爱尔康)公司研发的TRYPTYR®(0.003%acoltremon滴眼液)(前称AR-15512),用于改善干眼症(DED)的体征与症状。
此次获批基于两项Ⅲ期临床试验数据,研究共纳入930余名有干眼症病史的患者,按1:1比例随机分配至TRYPTYR®治疗组或赋形剂对照组。在COMET-2试验(临床试验官网注册号:NCT05285644)与COMET-3试验(临床试验官网注册号:NCT05360966)中,用药第14天时,TRYPTYR®治疗组患者自然泪液分泌量较基线增加至少10毫米的比例,最高达到对照组的4倍;其中COMET-2试验中两组比例分别为42.6%与8.2%,COMET-3试验中两组比例分别为53.2%与14.4%,两项试验差异均具有统计学意义(P均<0.0001)。且在整个90天的试验周期内,各时间节点均观察到一致的阳性结果。
TRYPTYR®采用一次性眼药瓶包装,推荐用法为双眼各滴1滴,每日两次。制造商预计该药物于2025年第三季度在美国正式上市。
1.2 VIZZ™
适应证:老视
药物类别:缩瞳剂
给药方式:滴眼液
FDA已批准LENZ的VIZZ™(1.44%乙酰胆碱滴眼液),这是首款基于乙酰胆碱成分的成人老视治疗滴眼液。该药物计划于2025年10月在美国推出样品,2025年第四季度中期实现全面上市。
VIZZ™的获批基于三项随机、双盲、对照Ⅲ期临床试验结果,分别为CLARITY 1(临床试验官网注册号:NCT05656027)、CLARITY 2(临床试验官网注册号:NCT06045299)以及CLARITY 3(临床试验官网注册号:NCT05753189)。
“在CLARITY 1与CLARITY 2两项临床试验中,VIZZ™达成了所有改善近视力的主要和次要终点指标,证实其可在用药后30分钟内改善近视力,且药效持续时间长达10小时。该药物耐受性良好,在三项CLARITY临床试验总计超过3万例治疗日中,未观察到与治疗相关的严重不良事件。”
二、生物类似药与仿制药:降低治疗成本,提升可及性
2.1 EYDENZELT®
适应证:湿性年龄相关性黄斑变性、视网膜静脉阻塞后继发性黄斑水肿、糖尿病性黄斑水肿及糖尿病视网膜病变
药物类别:血管内皮生长因子(VEGF)抑制剂
给药方式:玻璃体内注射
FDA批准Celltrion公司研发的EYDENZELT®(阿柏西普-boav注射液),该药物是EYLEA®(阿柏西普注射液,再生元公司研发)的生物类似药,获批适应症包括湿性(新生血管性)年龄相关性黄斑变性(wAMD)、视网膜静脉阻塞后继发性黄斑水肿(RVO)、糖尿病性黄斑水肿(DME)以及糖尿病视网膜病变(DR)。
阿柏西普是一种用于眼部注射的血管内皮生长因子抑制剂,通过抑制血管内皮生长因子-A(VEGF-A)和胎盘生长因子(PlGF)这两种参与眼部新生血管形成的生长因子,能够阻断眼部新生血管的生长,并降低眼内血管的通透性(减少血管内液体渗漏)。此次FDA批准是基于全面的证据,其中涵盖分析数据、非临床研究数据以及临床研究数据。
2.2 0.05%环孢素眼用乳剂
适应证:干眼症
药物类别:局部免疫调节剂
给药方式:滴眼液
FDA批准了Amneal制药研发的无菌无防腐剂配方0.05%环孢素眼用乳剂仿制药,该药品采用一次性眼药瓶包装。此产品为Restasis®(0.05%环孢素眼用乳剂)的等效仿制药,原研药Restasis®是艾伯维旗下子公司Allergan的注册商标。
0.05%环孢素眼用乳剂作为局部免疫调节剂,适用于因干眼症相关眼部炎症导致泪液分泌减少的患者,可提升其泪液生成量。该药物最常见的不良反应为眼部灼烧感。
2.3醋酸泼尼松龙滴眼液
适应证:类固醇敏感性眼部炎症
药物类别:糖皮质激素
给药方式:滴眼液
FDA批准Amneal公司的无菌型1%醋酸泼尼松龙滴眼液,该药物为Allergan(艾尔建)公司Pred Forte®(醋酸泼尼松龙滴眼液)的仿制药。美国药典标准的1%醋酸泼尼松龙滴眼液是一种无菌局部抗炎药物,适用于治疗类固醇敏感性眼部炎症。
临床研究显示,醋酸泼尼松龙滴眼液最常报告的不良反应包括眼压升高、可能诱发青光眼,此外还偶见视神经损伤、后囊膜下白内障形成以及伤口愈合延迟等情况。
2.4二氟泼尼酯滴眼液仿制药
适应证:眼科手术后的炎症和疼痛
药物类别:局部眼用皮质类固醇
给药途径:滴眼液
美国食品药品监督管理局(FDA)已批准Caplin公司生产的二氟泼尼酯滴眼液仿制药上市。二氟泼尼酯是一种皮质类固醇,用于治疗眼科手术后的炎症和疼痛,也可用于治疗眼内炎症。该获批药物与Durezol(山德士公司)疗效相当。
2.5盐酸奥洛他定滴眼液(0.2%)
适应证:眼部过敏
药物类别:抗组胺药
给药方式:滴眼液
Glenmark研发的盐酸奥洛他定滴眼液(美国药典标准,0.2%浓度)获得FDA批准,该药物为非处方药(OTC)。
这款非处方药与Alcon公司的Pataday Once Daily Relief Ophthalmic Solution(0.2%盐酸奥洛他定滴眼液)具有生物等效性,获批后Glenmark公司可在美国市场将其作为Pataday的替代产品,用于治疗眼部过敏相关症状。
三、新剂型与新适应证:优化治疗方案
3.1 EYLEA HD®
适应证:视网膜静脉阻塞后继发性黄斑水肿
药物类别:血管内皮生长因子抑制剂
给药方式:玻璃体内注射
FDA批准了8毫克规格EYLEA HD®(阿柏西普注射液)用于治疗视网膜静脉阻塞(RVO)后继发性黄斑水肿。该疗法在初始每月给药阶段后,可调整为每8周给药一次。同时,FDA还批准了该药物的每月(每4周)给药方案,适用于部分经获批适应证的患者,具体包括湿性年龄相关性黄斑变性、糖尿病性黄斑水肿、糖尿病视网膜病变以及视网膜静脉阻塞。
公告称:“此次EYLEA HD®获批用于视网膜静脉阻塞的治疗,依据是一项名为QUASAR的Ⅲ期临床试验数据。该试验对比了EYLEA HD®与2毫克规格EYLEA®(阿柏西普注射液)在视网膜静脉阻塞患者中的疗效与安全性。QUASAR试验在第36周达到主要终点,每8周给药一次的EYLEA HD®组患者(经过3次或5次初始每月给药后),其视力改善效果与每4周给药一次的EYLEA®组相比,达到非劣效标准。”
3.2 Susvimo®(6月审批)
适应证:糖尿病视网膜病变
药物类别:抗血管内皮生长因子(VEGF)抑制剂
给药方式:眼内植入剂
FDA已批准Genentech(基因泰克)公司研发的Susvimo®(兰尼单抗注射液,浓度100毫克/毫升)用于治疗糖尿病视网膜病变(DR)。此次获批基于Ⅲ期Pavilion临床试验(临床试验官网注册号:NCT04503551)为期1年的阳性结果。
新闻稿指出:“这是首款且唯一一款获得FDA批准的持续给药型治疗产品,研究证实其可维持糖尿病视网膜病变患者的视力,且仅需每9个月补充给药一次。目前,Susvimo®已面向美国视网膜专科医生及其接诊的糖尿病视网膜病变患者开放使用,适用人群为既往接受过至少两次抗血管内皮生长因子(VEGF)注射且应答良好的患者。”
Susvimo®此前已于2021年获批用于湿性年龄相关性黄斑变性的治疗,并于2025年2月新增糖尿病性黄斑水肿适应证。
3.3 Susvimo®(2月审批)
适应证:糖尿病性黄斑水肿
药物类别:抗血管内皮生长因子(VEGF)药物
给药方式:玻璃体内植入
FDA已批准Genentech(基因泰克)公司研发的Susvimo®(兰尼单抗注射液)用于治疗糖尿病性黄斑水肿(DME)。
Susvimo®是一种眼内植入装置,通过基因泰克公司研发的“眼内给药平台(Port Delivery Platform)”,实现兰尼单抗定制配方的持续释放。该装置的设计目的是减少患者所需接受的注射治疗次数,从而减轻治疗负担。
此次Susvimo®获批糖尿病性黄斑水肿适应证,使其治疗领域进一步拓展,此前该药物已于2021年获批用于湿性年龄相关性黄斑变性的治疗。
3.4 Dextenza®
适应证:眼科术后眼部炎症与疼痛(拓展至儿科人群)
药物类别:糖皮质激素
给药方式:眼内缓释泪小管植入剂
FDA批准Ocular公司研发的Dextenza®(地塞米松眼内缓释泪小管植入剂)拓展适用人群,纳入儿科患者。此次FDA批准的Dextenza®新增适应证,包括用于治疗成人及儿科患者眼科手术后的眼部炎症与疼痛。
此外,该药物还获批用于治疗成人及2岁以上儿科患者过敏性结膜炎相关的眼部瘙痒。但需注意,对于因过敏性结膜炎需使用该植入剂治疗眼部瘙痒的儿科患者,若植入操作需要对儿童进行镇静,则不建议使用该产品。
3.5 Epioxa™
适应证:圆锥角膜
药物类别:局部眼科治疗药物
给药方式:滴眼液
FDA通过新药申请(NDA)途径批准了Glaukos公司研发的Epioxa™HD/Epioxa™(依匹奥沙滴眼液)。该药物是一种无创性局部治疗方案,用于圆锥角膜的治疗,给药方式为序贯点眼,并在角膜交联术中配合紫外线照射激活药效。
此次获批基于两项前瞻性、随机、多中心、双盲Ⅲ期关键性临床试验数据,两项试验共纳入超过400名圆锥角膜患者。“Epioxa™的获批为圆锥角膜患者带来了全新的标准治疗方案,它是首款无需去除角膜上皮即可使用的FDA批准局部药物。该药物能够显著提升患者治疗舒适度,缩短术后恢复时间,堪称圆锥角膜治疗领域的革命性突破。”
3.6 Izervay™(阿伐新普肽)
适应证:年龄相关性黄斑变性继发地图样萎缩
药物类别:补体抑制剂
给药方式:玻璃体内注射
FDA批准Astellas(安斯泰来制药)公司研发的Izervay™(阿伐辛普肽玻璃体内注射液)拓展适应证标签,用于治疗年龄相关性黄斑变性(AMD)继发的地图样萎缩(GA)。此次更新后,阿伐辛普肽的用药时长限制被取消,此前获批的12个月用药期限要求被移除。此次审批决策是在安斯泰来制药公司针对FDA反馈意见提交补充新药申请资料后做出的。阿伐辛普肽最初于2023年8月获批上市,临床数据证实其在延缓地图样萎缩病变进展方面具有显著疗效。
3.7 Encelto™
适应证:2型黄斑毛细血管扩张症
药物类别:基因治疗
给药方式:玻璃体内植入
FDA已批准Neurotech公司研发的Encelto™封装细胞治疗植入剂,用于治疗2型黄斑毛细血管扩张症(MacTel)。此次获批基于两项Ⅲ期临床试验结果,研究显示,患者植入该装置后,在接下来的24个月内,黄斑感光细胞的丢失情况得到显著改善。
Encelto™封装细胞治疗植入剂预计于2025年6月起正式面向美国患者供应。








