甲状腺眼病(Thyroid Eye Disease, TED),又称格雷夫斯眼病(Graves’ Ophthalmopathy),是一种由自身免疫反应驱动的疾病,其典型特征包括眼眶组织的慢性炎症与结构重塑,可导致不可逆的容貌改变甚至视力丧失。目前,糖皮质激素是临床一线治疗手段,但其疗效有限,亟需开发基于疾病发病机制的靶向干预策略。促甲状腺激素受体(Thyroid-Stimulating Hormone Receptor, TSHR)是甲状腺眼病(Thyroid Eye Disease, TED)中的关键自身抗原靶点,在疾病的发生与发展中发挥核心作用。然而,针对TSHR的抑制剂研发长期面临抑制效力不足、特异性欠佳、作用机制不明确等挑战。因此,开发高效特异的TSHR抑制剂对TED的治疗具有重要意义。
近日,瓯江实验室/温州医科大学吴文灿教授和吴建章教授与湖南大学叶茂教授联合在Advanced Science(中科院1区Top ,IF:14.1)上在线发表了题为TSHR-Targeting Nucleic Acid Aptamer Treats Graves' Ophthalmopathy via Novel Allosteric Inhibition 的研究论文。该研究开发了靶向TSHR的功能性核酸适体YC3,其通过结合新发现的变构位点有效抑制受体激活,显著缓解眼眶成纤维细胞的炎症反应、细胞外基质过度分泌和异常脂肪分化,并在小鼠模型中显著改善眼部病变。该成果不仅为甲状腺眼病提供极具前景的候选新药,更揭示了TSHR上潜在的可成药变构位点,彰显核酸适体在药物开发中的独特优势。

研究团队通过Cell-SELEX结合功能筛选技术,获得了特异性靶向TSHR的核酸适体YC3。YC3对TSHR具有纳摩尔级亲和力和强大的药理学活性。机制研究显示,YC3通过结合TSHR胞外区亮氨酸重复结构域(Leucine-Rich Repeat Domain, LRRD)中一个此前未被识别的变构位点,调控受体构象变化从而抑制其激活。功能实验表明,YC3能有效逆转刺激型促甲状腺激素受体抗体(M22)驱动的原代人眼眶成纤维细胞过度激活,显著抑制炎症因子和细胞外基质的分泌,并抑制细胞脂肪分化,从而缓解成纤维细胞的致病性表型。
药代动力学研究结合活体成像显示, YC3 能特异性富集于眼眶和甲状腺组织。核磁共振成像及眼眶病理分析进一步证实,眶周注射YC3后,小鼠眼眶的炎症细胞浸润、细胞外基质沉积和脂肪增生均显著减轻。此外,小鼠的甲状腺功能指标(包括T3、T4及TRAb水平)均明显改善。值得注意的是,治疗过程中未观察到明显的器官毒性或体重下降,表明 YC3 具有良好的生物安全性,展现出良好的临床转化潜力。
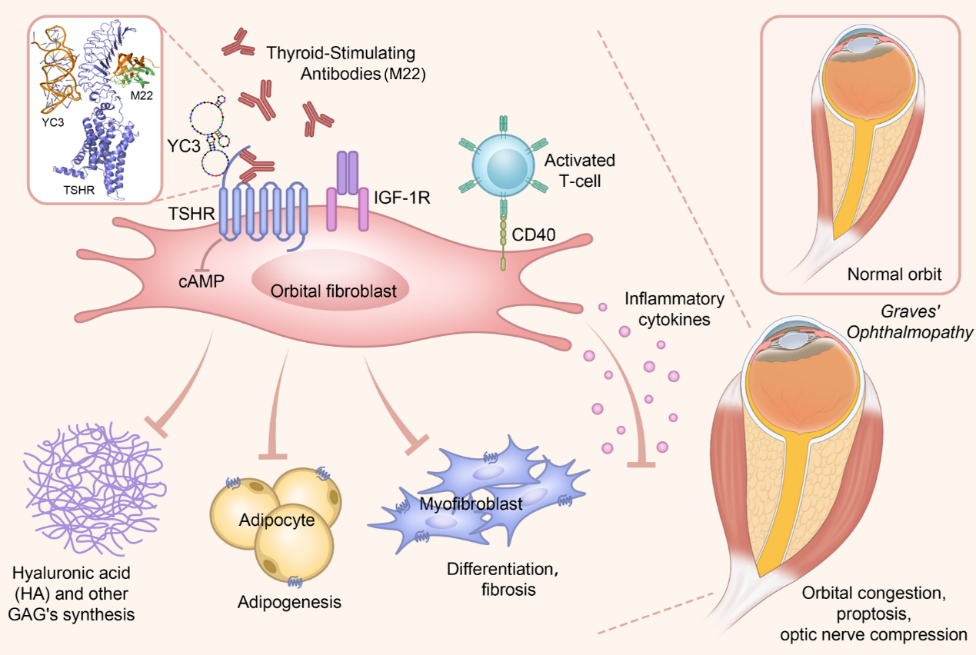
综上所述,本研究成功开发了一类靶向TSHR的新型核酸适体抑制剂,首次发现位于TSHR亮氨酸重复结构域中的变构抑制位点,为下一代靶向TSHR的变构药物设计奠定了基础。研究成果不仅为甲状腺眼病的治疗提供了候选新药,也有望为其他TSHR相关疾病提供变构抑制剂设计的新策略。同时,该工作凸显了功能性核酸适体在解析复杂受体调控机制、发现“隐匿性”可成药位点方面的独特优势,为攻克其它“难成药”靶点提供了重要范式。
瓯江实验室/温州医科大学吴文灿和吴建章教授与湖南大学叶茂教授为文章的共同通讯作者。张嫣宸、吴恩德和刘维斌为文章共同第一作者。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202505586








